La hemoglobina es una proteína localizada en el interior del hematíe, que constituye el 95% de su peso total. Su función es la de transportar el oxígeno desde los pulmones a los diversos tejidos del organismo.
En los pulmones la hemoglobina se une al oxígeno dando lugar a la formación de oxihemoglobina (HbO2). En los tejidos el O2 es liberado y la hemoglobina se reduce a desoxihemoglobina, hemoglobina que mantiene el hierro en estado reducido y por tanto tiene capacidad para captar nuevas moléculas de O2.
- Estructura de la hemoglobina.
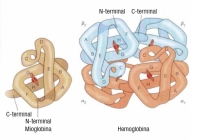
La hemoglobina está constituida por una parte proteica y una parte no proteica. La parte proteica o globina son polipéptidos. Existen 6 tipos de cadenas de globina denominadas por letras griegas: Alfa (α), Beta (β), gamma (γ), delta (δ), épsilon (ε) y zeta (ζ). Cada molécula de hemoglobina contiene cuatro cadenas iguales dos a dos. En la imagen se observa la estructura de la mioglobina a la izquierda y de la hemoglobina a la derecha. Los grupos hemo se representan como discos de color rojo.
En la siguiente tabla se muestran algunos ejemplos de hemoglobinas presentes en las personas adultas y la proporción en la que se encuentran.
Tipos de hemoglobinas presentes en el adulto.
| Hemoglobina |
Tipos de globinas |
Características |
| Hb A. |
α2 β2 |
La principal hemoglobina del adulto (96 %). |
| Hb F Fetal. |
α2 γ2 |
Predomina durante la vida fetal. En el adulto (1 %). |
| Hb A2. |
α2δ2 |
Es una hemoglobina menor en el adulto (de un 2 a un 3 %). |
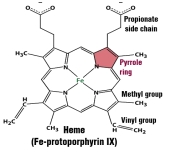
La
parte prostética está c
onstituida por el grupo Hemo. Es el componente no proteico de la hemoglobina y a él se debe el color rojo de la sangre. Estructuralmente se compone de una porfirina (protoporfirina IX) y un átomo de hierro en estado reducido (Fe2+) en el centro.
Cada átomo de Hierro puede fijar, de forma reversible, una molécula de oxígeno. Por tanto, cada molécula de hemoglobina puede fijar un máximo de 4 moléculas de O2, en esta situación decimos que está saturada. La hemoglobina sólo puede fijar oxígeno cuando el Hierro se encuentra en forma reducida (Fe2+). Si, por el contrario, se encuentra en forma oxidada (Fe3+), no puede hacerlo perdiendo su función respiratoria, y se denomina metahemoglobina.
La hemoglobina, en determinadas condiciones, puede fijar otros gases que son tóxicos para el organismo ya que impiden el transporte de O2.
- Carboxihemoglobina: cuando fija monóxido de carbono.
- Sulfohemoglobina: cuando fija azufre.
Compuesto formado por la combinación de más de diez aminoácidos.
Es una proteína muscular, estructuralmente y funcionalmente muy parecida a la hemoglobina, contiene un grupo hemo con un átomo de hierro, y su función es la de almacenar y transportar oxígeno.
Sustancia orgánica compuesta por un anillo tetrapirrólico y un átomo metálico central. Las más importantes son las protoporfirinas que forman parte de la hemoglobina (grupo prostético) y otras proteínas.

