Actividad nº 1:
Las conclusiones que se saquen del análisis de las fotografías deben ser lógicas, teniendo en cuenta los criterios comentados en contenidos. En algunos casos no será posible todavía determinar si la célula eucariota que se está viendo corresponde a un quiste de protozoo, o una levadura, aunque el alumno puede dar una identificación "presuntiva" basándose en imágenes analizadas en esta unidad. Los contenidos relacionados con estos aspectos se ampliarán en la unidad de trabajo 4.
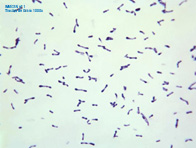
Imagen1: Frotis de un cultivo teñido con la tinción de gram. Se pueden observar bacterias, bacilos gram positivos de morfología irregular con uno de los extremos ensanchados (maza), que se presentan aislados y en formaciones en V o alas de gaviota. No parecen tener esporas.
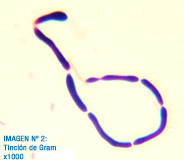
Imagen 2: Frotis teñido con la tinción de gram. Se observa un microorganismo de forma filamentosa. Por el tamaño a 1000x podría corresponder a células eucariotas. Parece que hay pared celular entre ellas, posiblemente se trate de un hongo (pseudohifa de levadura).
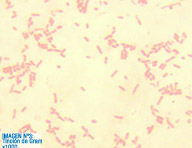
Imagen 3: Frotis teñido con la tinción de gram. Se observan bacterias, con morfología tipo bacilos, bordes redondeados. Son gram negativos y aparecen aislados (se considera siempre la forma que predomina).
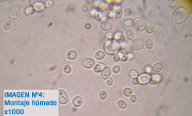
Imagen 4: Montaje húmedo. Se observan organismos eucariotas (son grandes a 1000x). Morfología redonda u ovalada. En el interior de las células se puede distinguir el núcleo y alguna vacuola. En el exterior de la célula se puede apreciar una estructura birrefringente sin tinción, corresponde a la pared celular de las levaduras.
Actividad nº 2:
- Preparación del material necesario para la tinción: rejilla de tinción, portaobjetos, asa de siembra, mechero Bunsen, rotulador/lapicero, pinzas de madera, agua.
- Identificación del portaobjetos.
- Colocación de una gota de agua en el portaobjetos (sólo si se parte de una colonia).
- Transferencia de la muestra al portaobjetos, homogenización.
- Secado de la extensión al aire.
- Fijación por calor. Punto Crítico.
- Aplicación de cristal violeta: 1 minuto
- Lavar con agua abundante: TODAS las bacterias estarán teñidas de color azul.
- Aplicación de yodo-lugol: 1 minuto
- Lavar con abundante agua: TODAS las bacterias de color azul.
- Aplicación de la solución de decoloración: Hasta que deje de salir color (aproximadamente 3 segundos)
- Lavar con agua abundante - Bacterias Gram positivas teñidas de azul - Bacterias Gram negativas, incoloras.
- Aplicación de safranina, 1 minuto
- Lavar con agua abundante - Bacterias Gram positivas de color azul - Bacterias Gram negativas de color rojo.
Actividad nº 3:
- Material que se necesitaría:
- Gradilla para colocar el tubo con el microorganismo cultivado.
- Tubos de vidrio vacíos de 10 ml por ejemplo.
- Gradilla para colocar los 3 tubos de vidrio. ( podría utilizarse también la misma que para la muestra)
- Una pipeta de vidrio o de plástico de 10 ml con su auxiliar de pipeteado. Otra posibilidad es utilizar una micropipeta de 1000 µl.
- Caja de puntas azules en caso de utilizar la micropipeta.
- Un contenedor amarillo para las puntas azules.
- En el caso que se utilice la pipeta de 10 ml, es necesario tener una papelera cerca de la cabina.
- Procedimiento:
- Puesta en marcha de la cabina de seguridad y dejarla en funcionamiento 15 minutos antes de su uso.
- Desinfección de la superficie de trabajo con alcohol al 70%.
- Colocación del material en la cabina. Introduciremos este material en la cabina y lo ordenaremos en la superficie de trabajo de tal forma que los movimientos de los brazos para acceder a ellos sean los mínimos posibles.
Ejemplo: Si somos diestros: Colocaremos a nuestra derecha la micropipeta, y el contenedor amarillo; la muestra a nuestra izquierda y la gradilla con los tubos para las alícuotas en el centro.
- Homogenizar la muestra por rotación del tubo entre las manos.
- Quitar el tapón al tubo.
- Transferir el volumen a los tubos apoyando la punta de la pipeta en la pared del tubo, para que el líquido se deslice suavemente por las paredes.
- Repetir la operación con los tubos siguientes (no es necesario cambiar de punta o de pipeta).
- Cerrar el tubo de cultivo y los tubos de las alícuotas.
- Sacar el material de la cabina.
- Desinfectar la superficie de trabajo con alcohol al 70%.
- Mantener la cabina en funcionamiento 10 minutos antes de apagarla.
- Medidas de seguridad que adoptarías en la operación:
Se trata de un microorganismo de nivel 3 de riesgo, por tanto todos los procedimientos habrá que realizarlos utilizando una Cabina de Seguridad de nivel II o mayor, para minimizar el riesgo de inhalación de los aerosoles formados durante la manipulación de la muestra.
La homogenización de la muestra haciendo rotar el tubo entre las manos disminuye el riesgo de generación de aerosoles.
Equipos de protección: Bata, guantes, mascarilla (opcional).
La desinfección de la cabina con alcohol al 70% y el mantenerla en funcionamiento 10 minutos antes de apagarla pueden ser consideradas también medidas de seguridad.