¿Cómo podemos controlar la cantidad de células que colocamos en cada uno de los frascos tras la tripsinización?
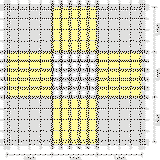
Realizando un recuento celular. Para ello, podemos utilizar diferentes aparatos. Más simples, como puede ser una cámara de recuento o más complejos como el Cell-Counter. El Cell-Counter, mide cambios en la resistencia eléctrica producidos cuando una partícula en suspensión no conductora atraviesa un pequeño orificio. Es un método rápido que permite contar altas densidades de células. Sin embargo, en la mayoría de los laboratorios se usan cámaras de recuento. Una cámara de recuento es una lámina de vidrio de forma rectangular de tamaño algo mayor que un portaobjetos. En la cámara, hay dos zonas de conteo (retículos) que llevan grabadas unas cuadrículas, superior e inferior, separadas por una hendidura. Sobre ellas se coloca un cubreobjetos que deja un hueco entre él y la cámara que se llena con el líquido de la suspensión celular.
Existen varios tipos de cámaras de recuento, la más utilizada es la Neubauer. Sus retículos tienen una superficie de 9 mm2 (3 mm por cada lado) y están divididos en 9 cuadrados secundarios de 1 mm2 de superficie. La profundidad de esta cámara es de 0,1 mm.
Para contar empleamos los 4 cuadrados secundarios de las esquinas. Cada uno de ellos está dividido en 16 cuadrados.
Para tener éxito en el cultivo, es importante calcular cuántas de estas células son viables tras el proceso de tripsinización. Para ello utilizamos un colorante vital denominado azul de tripán.
El azul de tripán es un colorante que está negativamente cargado, igual que la superficie celular, por lo que no puede penetrar en las células vivas. Esta tinción permite detectar las células vivas de las muertas. Si las células están vivas, tendrán intacta su membrana plasmática y el azul tripán no penetrará más allá de la membrana de la célula, de manera que las células se verán con el borde azulado. Si las células están muertas, el azul tripán penetrará fácilmente a través de la membrana plasmática, tiñendo la célula de azul. Esta solución se preparará en proporción 1:1 respecto a la cantidad de suspensión celular que utilicemos para hacer el recuento, de forma que las células quedarán diluidas a la mitad, y esta dilución deberá tenerse en cuenta en los cálculos finales.
Procedimiento:
- Mezcla 1 parte de la suspensión celular (por ejemplo 0,5 ml) y una parte de colorante azul de tripán (0,4 %).
- Incuba la mezcla 5 minutos a temperatura ambiente.
- Monta y llena las cámaras del hemocitómetro con 10 µl de la mezcla.
- Cuenta bajo el microscopio a 40x únicamente las células no teñidas que serán las viables.
Para hacer el recuento deberás:
- Montar la cámara colocando un cubreobjetos especial sobre el retículo.
- Homogeneizar bien la suspensión celular y rellenar la cámara con la solución a medir. Se realiza colocando la punta de la micropipeta en el borde del cubreobjetos, en la zona donde está el retículo. El líquido penetra por capilaridad, caben unos 10 µl. Hay que tener cuidado para que no se formen burbujas.
- Permitir que las células se depositen en el fondo del área de recuento durante unos minutos antes de contarlas.
- Enfocar el retículo con el objetivo de 10x, cambiar el objetivo a 40 aumentos. El recuento se hace recorriendo cada cuadrado en orden por ejemplo en zig-zag.
- Realizar el recuento solo en los cuatro cuadrados secundarios y suma las células obtenidas en ellos.
- Calcular la media de células por cuadrado secundario.
Existe una regla que debes seguir para contar y que evitará que cuentes algunas células dos veces. Se aplica a todas aquellas células que caen sobre las líneas del retículo. En estos casos sólo se deben contar las células que caigan encima de los bordes superior y derecho de cada cuadrado, dejando de contar las que caigan en los bordes inferior e izquierdo.
Los resultados se expresan en número de células por mililitro.
Nº de células/ ml = nº células contadas / nº cuadrados secundarios contados • Factor de dilución • 104
.
Siendo:
- El Factor de dilución: el inverso de la dilución previa de la muestra que se ha realizado. Si hemos usado azul tripán para hacer el recuento, deberemos multiplicar por 2. Si las células están muy concentradas, también es posible realizar una dilución previa y también deberemos multiplicar por su factor de dilución.
- 104: Factor de conversión para dar el resultado en ml. Teniendo en cuenta la profundidad de la cámara (0,1 mm) y el tamaño de cada cuadrado secundario (0,1 mm), el volumen de cada cuadrado secundario es 1 mm x 1 mm x 0,1 mm = 0,1 mm3 . Y sabiendo que 1 mm3 es 10-3 ml.