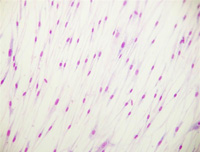
En esta imagen puedes observar el aspecto que tiene un cultivo de células realizado, en este caso, sobre un portaobjetos y posteriormente teñido con Giemsa. Este colorante tiñe el núcleo celular que es la parte de las células que aparece intensamente teñida en la imagen.
El cultivo de células tuvo su origen en el siglo XIX. Surgió como un método para el estudio del comportamiento de las células animales que, de este modo, se encontraban libres de las variaciones sistémicas ocurridas dentro del organismo. El concepto de mantener líneas de células vivas separadas del tejido de origen surge cuando el fisiólogo inglés Sydney Ringer desarrolló una solución salina (solución de Ringer) que contenía cloruro de sodio, potasio, calcio y magnesio. Esta solución era capaz de mantener latiendo el corazón de un animal fuera del cuerpo.
En 1866, Rechlinhausen, consiguió mantener vivas, por un corto periodo de tiempo, células sanguíneas de anfibio. El desarrollo del cultivo de células de vertebrados se inició con las observaciones de Roux 1885 en cultivos de células de embrión de pollo. Una serie de innovaciones como el desarrollo de medios de cultivo Eagle, 1955, el uso de antibióticos, las técnicas de tripsinización en 1952 y la suplementación del medio con suero fetal bovino, permitieron el desarrollo y aplicabilidad de los cultivos de células de origen vertebrado.
El cultivo celular es una parte muy importante del trabajo en un laboratorio de diagnóstico citogenético. Es necesario para obtener las metafases que se necesitan para el estudio de las alteraciones cromosómicas. Se puede definir como el conjunto de procedimientos que hacen posible el mantenimiento de las células de organismos pluricelulares in vitro, en medios de cultivo de composición química definida y en condiciones de temperatura, pH, aireación y humedad controladas, preservando sus características bioquímicas, genéticas y fisiológicas al máximo para asegurar su supervivencia y multiplicación, manteniendo todas sus funciones metabólicas de una manera semejante a las que tenían en el huésped.
El cultivo celular es el proceso por el cual tanto células procariotas como eucariotas pueden cultivarse en condiciones controladas. En la práctica el término cultivo celular ha venido a referirse al cultivo de células aisladas de eucariotas (pluricelulares), especialmente células animales.
¿En qué consiste un cultivo celular?
El objetivo del cultivo es proporcionar a las células, en un ambiente artificial (
in vitro), unas condiciones óptimas para que se dividan. Estas condiciones incluyen además de nutrientes unos valores de
pH, temperatura,
presión osmótica y concentración de gases adecuados.
Aunque potencialmente se puede obtener un cultivo de cualquier tipo de tejido, normalmente los que mejor funcionan son los cultivos de células embrionarias, células que todavía conservan la capacidad de división, como las células del trofoblasto o las de la médula ósea.
Los cultivos de células tumorales también funcionan bien ya que sus células tienen la capacidad de dividirse indefinidamente. Sin embargo si queremos obtener metafases de otros tejidos, como sangre o tejidos como la piel, deberemos inducir su división artificialmente, bien utilizando mitógenos o mediante factores de crecimiento que ayuden a las células a dividirse.
Podemos definir a los mitógenos como todas aquellas sustancias añadidas al cultivo que inducen la proliferación de sus células in vitro.
Existen varias sustancias que realizan esta función, como el extracto de levadura, o mitógenos vegetales como la concanavalina A y la fitohemagluitinina. Estas sustancias pueden actuar selectivamente sobre un tipo específico de células. Así por ejemplo la fitohemaglutinina activa únicamente la proliferación de los linfocitos T mientras que la concanavalina A activa tanto a los linfocitos B como T.
Es importante resaltar, que tal y como se recoge el el RD 664 / 1997 de 12 de mayo, sobre la protección de los trabajadores contra los riesgos relacionados con la exposición a agentes biológicos durante el trabajo, en su artículo 2, se define el cultivo celular como el resultado del crecimiento in vitro de células obtenidas de organismos multicelulares, considerándolo como un agente biológico. Y establece las disposiciones mínimas aplicables a las actividades en las que los trabajadores estén o puedan estar expuestos a agentes biológicos debido a la naturaleza de su actividad laboral.
¿Sabes cuáles son las diferencias fundamentales entre células in vivo e in vitro?
Con respecto a las condiciones in vivo, en un cultivo in vitro existe:
- Perdida de la geometría tridimensional
- Perdida de interacciones celulares específicas
- Perdida de la regulación homeostática por el Sistema Nervioso y Endocrino
- Metabolismo energético se basa en la glicólisis
Podemos decir que las ventajas principales del método in vitro son:
- Control del medio y las condiciones de cultivo
- Caracterización y homogeneidad de las muestras
- Es más económico
- Motivaciones éticas respecto al uso de animales.
Por el contrario son desventajas a tener en cuenta:
- Necesidad de esterilidad estricta
- Cantidad y costo
- Inestabilidad de las células en cultivo con el paso del tiempo
- Los modelo in vitro deben ser validados por estudios in vivo
La tinción de Giemsa es un tipo de coloración de muestras clínicas, basada en la mezcla de colorantes ácidos y básicos. Su creación estuvo inspirada por el trabajo realizado por Romanowsky, donde Gustav Giemsa, químico y bacteriólogo originario de Alemania, la perfeccionó agregando glicerol para estabilizar los compuestos.
El pH es una medida de acidez o alcalinidad que indica la cantidad de iones de hidrógeno presentes en una solución o sustancia. El término fue designado por el químico danés Sørense al definirlo como el opuesto del logaritmo en base 10 o el logaritmo negativo de la actividad de los iones de hidrógeno, cuya ecuación es pH= -log10[aH+].
Entendemos por presión osmótica, a aquella que sería necesaria para detener el flujo de agua a través de una membrana semipermeable. Al considerar como semipermeable a la membrana plasmática, las células de los organismos pluricelulares deben permanecer en equilibrio osmótico con los líquidos tisulares que los bañan.
Capa celular que rodea a los blastómeros y que tiene como función la nutrición.
Lectina que induce aglutinación eritrocitaria y se comporta como un mitógeno para linfocitos T.
La fitohemaglutinina (PHA) es un lectina derivada de extractos de las semillas de Phaseolus vulgaris, se ha utilizado durante muchos años debido a sus propiedades ya que causa la aglutinación de los eritrocitos y estimula la mitosis en diferentes estirpes celulares, incluidos los linfocitos.
Sustancia que al introducirse en el organismo induce en este una respuesta inmunitaria, provocando la formación de anticuerpos.
Son organismos vivientes unicelulares. Estas células se caracterizan por no tener núcleo celular, sino tener su material genético disperso en el citoplasma, apenas reunido en una zona llamada nucleoide.