
¿Recuerdas la olla que pusiste al fuego?
Estas leyes que rigen el comportamiento de los gases ideales te permitirán comprender mejor qué es lo que sucede dentro de la olla:
- Ley de Boyle y Mariotte: Una masa de gas ideal realiza una Transformación isotérmica (T=Cte) cuando la presión de la misma esta en una relación inversamente proporcional al volumen que ocupa.
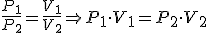
- 1º Ley de Gay – Lussac: Una masa de gas ideal realiza una Transformación isobárica (P=Cte) cuando la temperatura de la misma está en una relación directamente proporcional al volumen que ocupa.
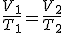
- 2º Ley de Gay – Lussac: Una masa de gas ideal realiza una Transformación isocórica (V=Cte) cuando la temperatura de la misma esta en una relación directamente proporcional a la presión que ejerce.
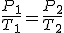
- Ley general de los gases ideales: Combinando las leyes anteriores se llega a que:
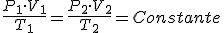
- Ecuación de estado de los gases ideales: La constante anterior depende del tipo de gas que se trate (Rp) y de la masa (m) del mismo de forma que:
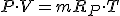
Es decir que según la fórmula, como la olla tiene un volumen determinado y constante al aumentar la temperatura aumenta la presión por lo que el vapor de agua empuja la tapa de la olla y sale al exterior.
La temperatura de las fórmulas anteriores siempre se toma en Kelvin.