ENERGÍA INTERNA
Un sistema termodinámico (una caldera, un motor de coche, una central térmica, el suelo radiante de una habitación, una tubería por la que circula vapor, etc.) poseen una cierta energía que llamamos energía interna (U), debida a la propia constitución de la materia (enlaces de la moléculas, interacciones entre ellas, choques térmicos....). Por lo tanto, la energía total de un sistema es la suma de su energía interna, su energía potencial (relacionada con la altura relativa a la que se encuentra), su energía cinética (debido al movimiento), y la debida al hecho de encontrarse sometido a la acción de cualquier campo. No obstante, en los sistemas térmicos suelen considerarse dos tipos de energía, la térmica, relacionada con la transferencia de calor y la mecánica, asociada a su posición (energía potencial) movimiento (cinética) y a su presión (piezométrica). El resto de las energías se considera que no varían al realizar los cálculos de instalaciones térmicas.
En consecuencia, la energía interna de un sistema varía cuando está realizando un trabajo (energía mecánica), o transfiriendose energía en forma de calor. Si varía la energía interna de nuestro sistema, debido a la Primera Ley de la Termodinámica, que veremos después, esta variación vendrá acompañada, en el exterior de nuestro sistema, de la misma variación de energía, pero de signo contrario. De este modo, la energía total del sistema más la del entorno, permanece constante. La energía del Universo permanece constante. La energía ni se crea ni se destruye, sólo se transforma. Por ejemplo, si calentamos un depósito lleno de agua, hasta que se evapora y mueve un ciclindro, nuestro sistema gana energía interna mientras se calienta el agua, pero al realizar un gasto energético para mover el cilindro, perderá esa misma energía interna y se transformará en trabajo útil. Esto lo pone de manifiesto la siguiente relación: ΔU = Q + W
Como resulta más conveniente considerar positivos, tanto el trabajo que realiza un sistema (realmente debería ser negativo según la fórmula anterior), como el calor aportado, la anterior fórmuladebe cambiar de signo y expresarse del modo usual:

Siendo:
ΔU: Variación de la energía interna en el sistema
Q: Calor transferido. El calor que absorbe el sistema se considera positivo y el cedido negativo.
W: Trabajo transferido. El trabajo que aporta el sistema al exterior se considera positivo y el que se realiza sobre el sistema negativo
Las unidades de medida son en formato de energía (J, kWh, cal, etc) o en el de energía específica por unidad de masa (J/kg, kcal/kg, etc.)
Desde el punto de vista de la termodinámica, en un sistema cerrado (o sea, de paredes impermeables), la variación total de energía interna es igual a la suma de las cantidades de energía comunicadas al sistema en forma de calor y de trabajo. Aunque el calor transmitido depende del proceso en cuestión, la variación de energía interna es independiente del proceso, sólo depende del estado inicial y final, por lo que se dice que es una función de estado, lo mismo que la entalpía, que vemos a continuación.
ENTALPÍA
La entalpía (H), mide la energía que un sistema termodinámico intercambia con su entorno y su ecuación es:

Siendo:
H: Entalpía. Con frecuencia se utiliza el concepto de entalpía específica (por unidad de masa)
U: Energía interna en el sistema
p: Presión. Puede ir variando en el proceso de transformación.
v: Volumen.
Las unidades de medida son, en el SI: J, Pa y m3
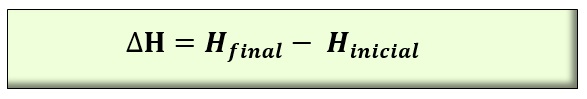
Los intercambios de energía pueden realizarse en forma de calor, lo que contribuye a la variación de la energía interna, o de trabajo, lo que se refleja en el producto de la presión por el volumen. La entalpía, al igual que la energía interna, se mide en unidades energéticas. En el caso de la entalpía es mucho más frecuente utilizar la entalpía específica por unidad de masa (kJ/kg), que no es otra cosa que la energía termodinámica que tiene un fluido por cada unidad de masa. Cuando un sistema pasa desde unas condiciones iniciales hasta otras finales, se mide el cambio de entalpía ( ΔH). Lo que hace la entalpía es reflejar la cantidad de energía que un cuerpo intercambia con el entorno. Sus fluctuaciones, de este modo, revelan el nivel energético que el cuerpo libera o absorbe.