CALOR ESPECÍFICO DE SÓLIDOS Y LÍQUIDOS
El calor específico c se define como la cantidad de energía necesaria para aumentar 1 ºC la temperatura de una masa de 1 kg. Es decir, es algo parecido a la capacidad que tiene un cuerpo para almacenar calor. Si tenemos que administrar mucha energía calorífica a un cuerpo para que aumente su temperatura (sabiendo que la energía no se crea ni destruye y, por consiguiente, está almacenada en este cuerpo), podemos concluir que su calor específico es mayor que en otro cuerpo en el que con el mismo calor, su temperatura aumenta rápidamente. Lo hemos visto en la simulación que hemos realizado anteriormente con el agua (mucho calor específico) y el bloque de hierro (menor calor específico).
Cada cuerpo tiene un calor específico distinto y lo debemos conocer si deseamos enfriar o calentar ese cuerpo para saber cuánto calor debemos aportar o quitar. A la sustancia más común en sistemas térmicos, el agua, se le ha dado el valor de 1 kcal/kg ºC (necesito 1 kilocaloría para subir 1 kg de agua 1ºC). Es decir, en el caso del agua resulta, c = 1 kcal/kgºC = 4,184 kJ/kgºC.
Los demás cuerpos, reciben valores en comparación con el agua, y tienen un valor inferior a ésta. Es decir, el agua es una de las sustancias con mayor capacidad para acumular calor. Esta es una gran ventaja, ya que suele ser un recurso muy accesible y es barata. Tiene el inconveniente de que, a presión atmosférica, se hiela a 0ºC. No obstante, las instalaciones de calefacción y climatización de edificios no necesitan temperaturas tan bajas en el fluido portador.
Por otro lado, sabemos que la cantidad de calor que hay que aportar a un cuerpo para subir su temperatura es proporcional a su masa. De este modo, obtenemos la ecuación básica siguiente:
Siendo:
Q: Energía calorífica que interviene (positiva si absorbe calor, ya que t2 > t1, y negativa si cede calor). En el SI, la unidad es J, pero se utiliza frecuentemente la kcal → 1 kcal = 4,184 kJ
m: Masa que interviene. Usualmente en kg
t:Temperaturas inicial y final. Aunque en el SI debe ir en K, es exactamente igual ponerlas en ºC, ya que la diferencia da el mismo resultado en ambas unidades.
c: Calor específico del cuerpo o sustancia. Las unidades empleadas en este valor determinarán las unidades restantes. Normalmente, este valor viene dado en el SI en kJ/kg·K (también kJ/kg·K), o en kcal/kg·ºC
Algunos valores de calores específicos los tenemos en la tabla siguiente:
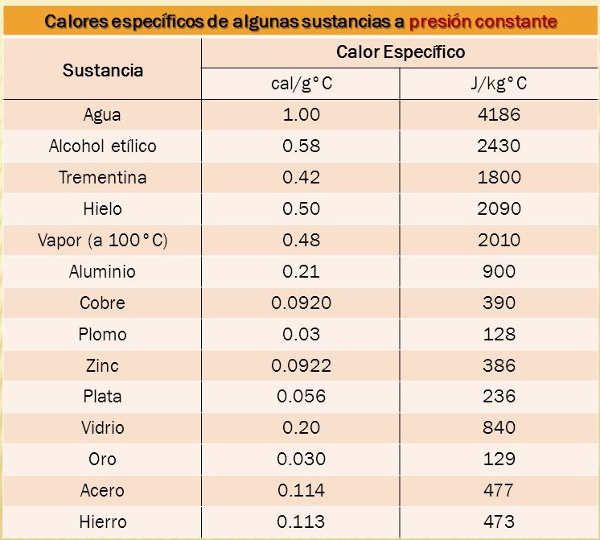
EQUILIBRIO TÉRMICO EN MEZCLAS
Cuando se mezclan dos o más sustancias a diferentes temperaturas, se produce un proceso por el que el calor del cuerpo más caliente pasa al cuerpo más frió. De este modo, al cabo del tiempo suficiente, se produce un equilibrio térmico en el que ambos cuerpos se encuentran a la misma temperatura. Esta temperatura de equilibrio está entre las dos temperaturas y su proximidad a una u otra depende de la masa de cada cuerpo, de sus temperaturas y de los calores específicos de cada uno de ellos. En estos casos se aplica el principio de las mezclas siguiente:

Si la mezcla es de dos o más sustancias que tienen el mismo calor específico, en la fórmula se elimina el calor específico y queda más simplificada, tal como vemos a continuación:
CALOR ESPECÍFICO DE LOS GASES
A diferencia de lo que sucede con sólidos y líquidos, los valores de los calores específicos de los gases dependen del proceso que experimentan. Dos procesos importantes son aquellos en los que se mantiene constante la presión o el volumen.
Todo el calor Qv que se suministra a un gas a volumen constante se invierte en incrementar la energía interna de las moléculas y aumentar su temperatura hasta T. Sin embargo, si se calienta un gas a presión constante, la energía calorífica suministrada Qp no sólo se invierte en aumentar su energía interna hasta la misma temperatura T, sino que, además, produce un trabajo mecánico al dilatarse el gas en cuestión W = p·ΔV, venciendo la presión constante exterior. Es decir, en el segundo caso debe aportarse más calor ΔQ y por tanto, el calor específico de un gas a presión constante (Cp ) es mayor que el correspondiente a volumen constante (Cv). Se demuestra que, en el caso de un gas perfecto de masa molecular M, la diferencia de los dos calores específicos es:
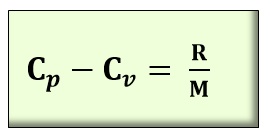
Siendo:
R: Constante universal de los gases perfectos, de valor 8,3145 J/mol.K = 1,986 cal/mol.ºC ~ 1,99 cal/mol.ºC
M: Masa molecular en kg/mol
La relación Cp/ Cv = γ (gamma). A temperaturas ordinarias, este factor vale:
En el estudio de las Leyes de la Termodinámica para gases utilizaremos este factor.

