1. La temperatura de 5 kg de N2 gaseoso se eleva desde 10 ºC a 130 ºC. Si se realiza el proceso a presión constante, hallar la cantidad de calor necesaria para ello, el incremento de energía interna y el trabajo exterior realizado por el gas. Calcular también el trabajo y la cantidad de calor necesaria si el proceso se lleva a cabo a volumen constante.
2. Se comprime adiabáticamente un volumen de 22,4 l de nitrógeno gaseoso a 0ºC y 1 atm, hasta la décima parte de su volumen inicial. Hallar, la presión y temperatura final, así como el trabajo que hay que realizar sobre el sistema.
3. Calcular el rendimiento termodinámico ideal de una máquina térmica que funciona entre dos focos a 100 ºC y 400 ºC de temperatura respectivamente.
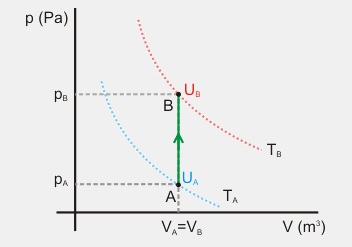
4. Explicar el proceso termodinámico que se representa en el siguiente gráfico y razonar cómo varían las magnitudes termodinámicas básicas
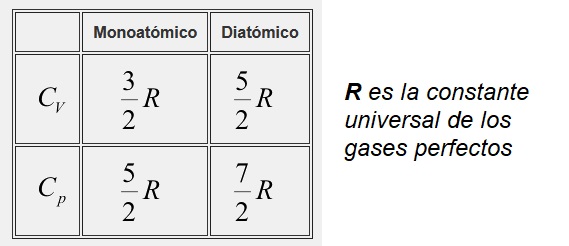
5. Se demuestra que la relación existente entre los calores específicos a presión y volumen constante de los gases monoatómicos y diatómicos, es la reflejada en la tabla. Se trata de obtener el coeficiente γ, necesario en los cálculos de una transformación adiabática, para el oxígeno y el aire.
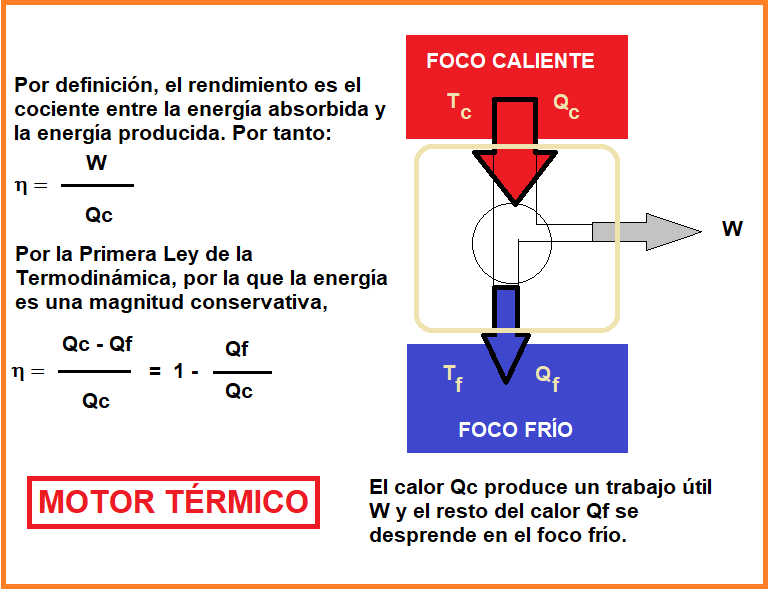
6. Observa el esquema del motor térmico y el cálculo de su rendimiento, ¿eres capaz de hacer un esquema similar pero funcionando el sistema como una máquina frigorífica? Pon las flechas en el sentido correcto y obtén el valor del rendimiento. Date cuenta que la energía útil es el calor que extraemos del foco frío.
7. Imagina ahora, que lo que tienes es una máquina térmica en la que utilices el calor del foco caliente como calefacción. Son las denominadas bombas de calor, que en verano funcionan como máquinas frigoríficas (como la vista en la solución del ejercicio anterior), y en invierno se invierte su funcionamiento y la energía eléctrica del compresor bombea el calor extraído de la calle al interior, ¿eres capaz de determinar la fórmula de su rendimiento?
8. A partir del simulador adjunto, abre las diferentes ventanas y realiza distintos experimentos. Comprueba si se ajustan los resultados a lo que se ha tratado a lo largo de esta unidad. Observa que podemos variar las cuatro magnitudes termodinámicas vistas: Presión, Volumen, Temperatura y masa (moles), por lo que la ecuación que rige el comportamiento del gas introducido es la ecuación de los gases perfectos.






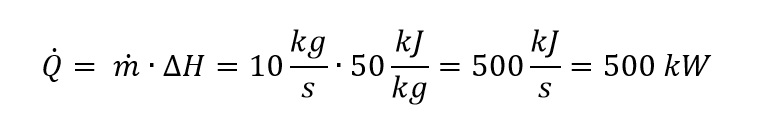 Observa que la Q, normalmente es energía térmica y, con el punto encima, indica una potencia térmica. Las potencias que no son térmicas, frecuentemente utilizan P.
Observa que la Q, normalmente es energía térmica y, con el punto encima, indica una potencia térmica. Las potencias que no son térmicas, frecuentemente utilizan P.