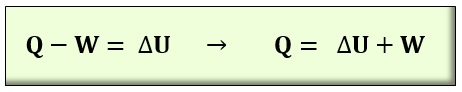
PRINCIPIO CERO DE LA TERMODINÁMICA.
La Temperatura. El equilibrio térmico se alcanza cuando los cuerpos tienen la misma temperatura. Podemos visualizar este principio en el programa Energy2D
PRIMERA LEY O PRIMER PRINCIPIO DE LA TERMODINÁMICA.
La Energía es una magnitud conservativa. Probablemente es una de las leyes más conocidas de la física, debido a un enunciado rotundo: "La energía ni se crea ni se destruye, sólo se transforma". Lo que esta ley nos dice es que en cualquier proceso en el que haya una transferencia de energía siempre hay una fuente de energía que va a perder esa energía y otra que la va a ganar a costa de la primera. Es decir si se gana energía, debe ser a costa de algo, y si se pierde, debe ir a algún sitio. No se puede crear energía (salvo de la propia materia: E=1/2mvc2).
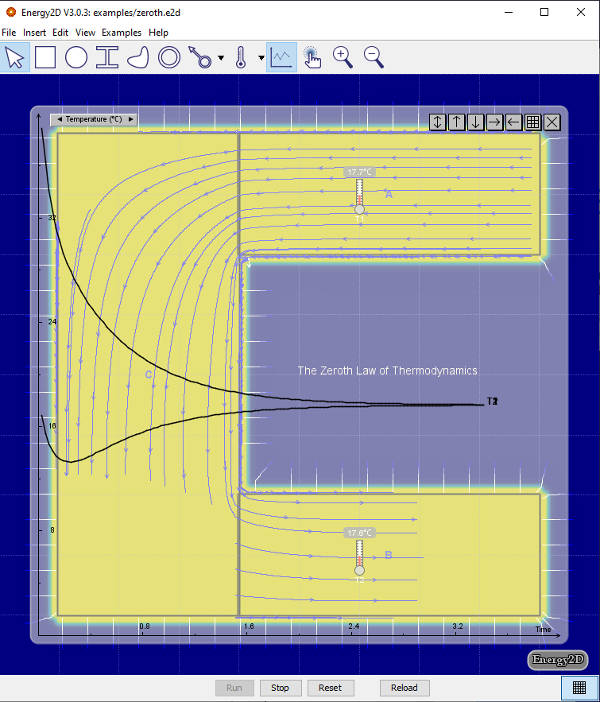
Sea un sistema en el que se introduce una cierta cantidad de calor Q y produce un trabajo exterior W. Si Q es mayor que W, la diferencia (Q-W) permanece en el sistema y se invierte en incrementar la energía interna, ΔU del mismo. Es decir:
En esta nueva formulación, Q sería positivo si entra en el sistema y W es positivo si sale del sistema (por eso aquí tenemos en la fórmula –W, Todas las magnitudes deben ir en las mismas unidades. Esta Primera Ley es en la que se basan todos los análisis de balance energético en instalaciones.
SEGUNDA LEY O SEGUNDO PRINCIPIO DE LA TERMODINÁMICA.
Restricciones en procesos térmicos. Irreversibilidad. El Primer Principio de la Termodinámica establece que la energía interna puede aumentar porque se realiza un trabajo sobre el sistema o porque se introduzca calor en él. Desde este punto de vista calor y trabajo son equivalentes energéticamente. Sin embargo, la experiencia diaria nos muestra que no es así, ya que existe una diferencia esencial entre ambos mecanismos de transferencia de energía. Podemos trasformar todo el trabajo en calor, pero no podemos transformar todo el calor en trabajo. Por ejemplo, si una estufa eléctrica calienta una habitación, no podemos invertir el proceso y recupefrar toda la energía eléctrica invertida a partir del mayor calor de la habitación.
Igualmente, la experiencia nos muestra que existe una dirección en el que ocurren los fenómenos. Sabemos que el calor va de los cuerpos calientes a los fríos y no al revés; que un gas tiende a expandirse ocupando todo el volumen posible, y no a contraerse; que por consecuencia de la fricción los cuerpos se paran, no se aceleran. Este sentido de evolución de los sistemas no está contenido en el primer principio de la termodinámica, sino que requiere un principio adicional, conocido como Segundo Principio de la Termodinámica.
La Segunda Ley nos dice que el calor fluye de forma natural de los cuerpos a mayor temperatura, a los de menor. Si queremos invertir ese proceso, necesitamos aplicar energía. Las máquinas frigoríficas son un ejemplo, necesitamos una máquina que consume energía para extraer calor desde un foco frío a otro caliente. Esta Segunda Ley nos dice, también, que la entropía de un sistema es siempre creciente. Esta segunda Ley también se conoce como la ley de la entropía creciente.
Pero, ¿qué es la entropía?. Es una variable de estado y no es un valor absoluto. Se mide calculando la diferencia de la entropía inicial de un sistema (Si) y la entropía final (Sf). Por lo tanto la entropía de un sistema sólo se puede calcular si este último ha sufrido variaciones en las condiciones normales del sistema. La entropía posee el símbolo S y mide el nivel de desorden o degradación de la energía.
Algunos sistemas podrían revertir los cambios que se hubieran realizado, a esto se le llama proceso reversible, cuya variación de entropía es cero. En cambio si el cambio de las condiciones en el sistema no puede volver a la normalidad se habla de un proceso irreversible, donde su entropía sería mayor que cero. En la naturaleza sólo se han visto procesos irreversibles. Por lo tanto se concluye que los sistemas tienden al desorden, en otras palabras, a aumentar su entropía. Otra consecuencia que podemos extraer de esta Segunda Ley es que no existe ningún proceso de transformación de energía 100% eficiente. En todas las máquinas vamos a tener unas pérdidas de energía en forma de calor que no se va a poder aprovechar.
Por ejemplo, si mezclamos 4 litros de agua a 20ºC con 8 litros de agua a 80ºC, obtenemos 12 litros de agua a 60ºC; pero no podemos obtener otra vez (sin aportar energía extra) los 4 y 8 litros de agua a las temperaturas iniciales.
La entropía, matemáticamente se define mediante la expresión.
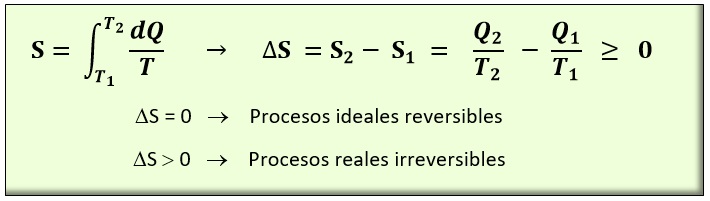
En donde:
S: Entropía, en las unidades del SI J/K (ya que su definición matemática es un calor-energía dividido entre una temperatura. Sería la variación de entropía que experimenta un sistema cuando absorbe el calor de 1 Julio a la temperatura de 1 Kelvin.
T2: Temperatura final en K
T1: Temperatura inicial en K
Q: Calor aportado o cedido en el proceso en J
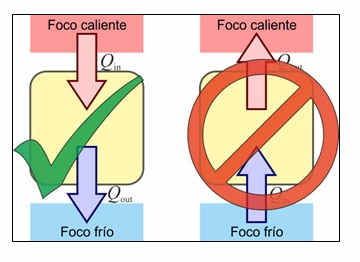
Otra manera de expresar el Segundo Principio de la Termodinámica es el denominado Enunciado de Clausius. El enunciado de Clausius del Segundo Principio de la Termodinámica prohíbe la existencia de refrigeradores ideales. Es imposible un proceso que tenga como único resultado el paso de calor de un foco frío a un foco caliente.
TERCERA LEY O TERCER PRINCIPIO DE LA TERMODINÁMICA.
Imposibilidad de alcanzar el cero absoluto 0 K = - 273ºC. Para alcanzar el 0 K hacía falta aplicar una energía infinita. Dicho de otro modo, era imposible alcanzar esta temperatura. Es algo parecido a la velocidad de la luz, que no se puede superar. Se demuestra que, conforme un objeto se acerca a la velocidad de la luz, se requiere más y más energía, hasta necesitarse una energía infinita. O sea, que esta velocidad nunca se puede superar. Lo mismo ocurre con el cero absoluto.
Recientemente, y después de 100 años de debate, alcanzar el cero absoluto ha sido declarado matemáticamente imposible. Después de más de 100 años de debate entre científicos, los físicos finalmente han ofrecido una demostración matemática de la tercera ley de la termodinámica, que establece que la temperatura de 0 K no se puede lograr físicamente porque es imposible que un sistema tenga cero de entropía.