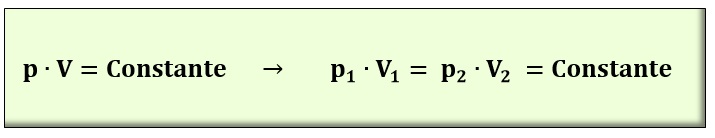VARIABLES TERMODINÁMICAS.
Las variables termodinámicas o variables de estado son las magnitudes que se emplean para describir el estado de un sistema termodinámico. Dependiendo de la naturaleza del sistema termodinámico objeto de estudio, pueden elegirse distintos conjuntos de variables termodinámicas para describirlo. En el caso de un gas, estas variables son:
- Masa (m): Es la cantidad de sustancia que tiene el sistema. En el Sistema Internacional se expresa respectivamente en kilogramos (kg) o en número de moles (mol).
- Volumen (V): Es el espacio tridimensional que ocupa el sistema. En el Sistema Internacional se expresa en metros cúbicos (m3). Si bien el litro (l) no es una unidad del Sistema Internacional, es ampliamente utilizada. Su relación, ya sabemos que es: 1 m3 = 1000 litros.
- Presión (p): Es la fuerza por unidad de área aplicada sobre un cuerpo en la dirección perpendicular a su superficie. En el Sistema Internacional se expresa en pascales (Pa). La atmósfera, el bar, y el mca (metro de la columna de agua) son unidades comúnmente utilizadas y que hemos visto sus equivalencias en apartados anteriores.
- Temperatura (T ó t): A nivel microscópico la temperatura de un sistema está relacionada con la energía cinética que tienen las moléculas que lo constituyen. Macroscópicamente, la temperatura es una magnitud que determina el sentido en que se produce el flujo de calor cuando dos cuerpos se ponen en contacto. En el En el Sistema Internacional se mide en Kelvin (K), aunque la escala Celsius se emplea con frecuencia. La conversión entre las dos escalas ya sabemos que es T (K) = t (ºC) + 273.
En la siguiente figura se ha representado un gas encerrado en un recipiente y las variables termodinámicas que describen su estado.
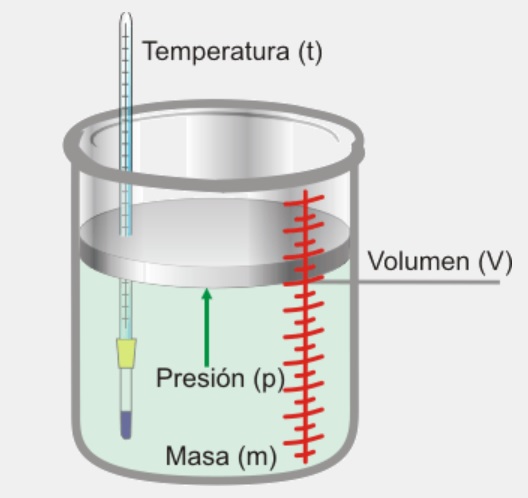
Los gases están constituidos por moléculas que están en un movimiento continuo y desordenado. Esto hace que ocupen todo el volumen del recipiente que los contiene. La presión que ejerce un gas sobre una superficie es debida a los choques de las moléculas del gas contra esa superficie. El estado de un gas, de una determinada masa, se caracteriza, especialmente, por las tres variables siguientes: presión, temperatura y volumen. En este ciclo formativo vas a trabajar con distintos tipos de fluidos: agua, refrigerantes, glicoles, aire, gases combustibles, etc, pero básicamente los podemos clasificar en dos grandes grupos: líquidos y gaseosos. En este apartado vas a estudiar las leyes básicas que rigen el comportamiento de los gases.
ECUACIÓN DE LOS GASES PERFECTOS
No existe una única ecuación de estado que describa el comportamiento de todas las sustancias para todas las condiciones de presión y temperatura. La ecuación de estado que describe el comportamiento de un gas ideal, a temperaturas y presiones no excesivamente altas o bajas, se llama ecuación de estado de un gas ideal y cumple las denominadas leyes de Boyle y de Charles.
LEY DE BOYLE. La ley de Boyle (1662) da una relación entre la presión de un gas y el volumen que ocupa a temperatura constante. Dicha ley establece que el producto de la presión por el volumen de un gas a temperatura constante es constante. Matemáticamente:
Esta ley se cumple para un gas perfecto que pasa de un estado 1 (p1, V1) a un estado 2 (p2, V2). Los valores de p y V deben ir cada cual en las mismas unidades.
Si representamos esta ecuación en un sistema de coordenadas pV, obtenemos una hipérbola para la temperatura correspondiente T, tal como se ve en el gráfico, donde un gas a alta presión y pequeño volumen, se expande hasta ocupar un volumen mayor y une presión menor (Estado 1 → Estado 2):
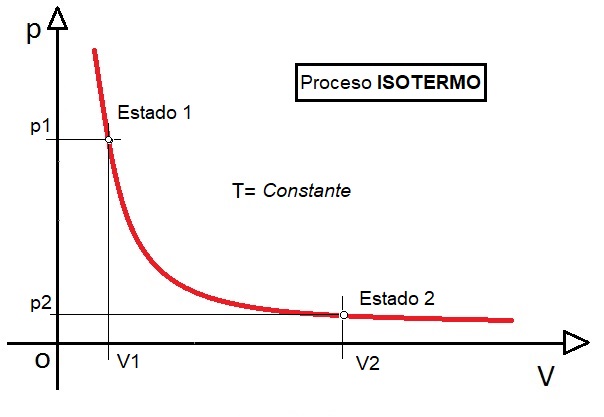
Lo singular de una hipérbola es que tiene dos asíntotas, una horizontal y otra vertical. Una asíntota es esencialmente una línea a la que se acerca una curva mientras se dirige al infinito. La explicación física de la existencia de estas asíntotas es el hecho de que no importa cuánto aumente la presión, el volumen nunca puede ser cero. Del mismo modo, la presión nunca puede ser cero, ya que esto significaría un volumen infinitamente grande. La siguiente animación muestra el proceso

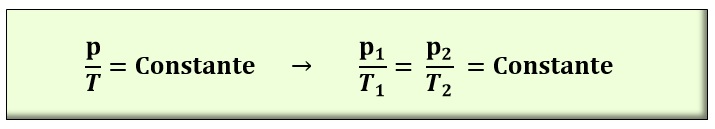
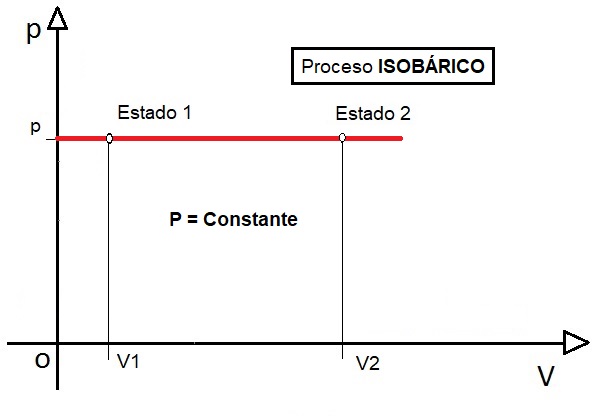
LEY DE CHARLES. La ley de Charles (1787) establece que, a presión constante, el cociente entre el volumen que ocupa un gas y su temperatura, expresada en Kelvin, es una constante. En este caso, se cumple la ecuación:
La representación gráfica en un diagrama P-V es como sigue, donde el volumen aumenta debido al aumento de temperatura (Estado 1 → Estado 2).
En la siguiente animación, podemos ver el comportamiento de un gas en el que la presión permanece constante. En la representación gráfica, se han relacionado T y V en el gráfico cartesiano.
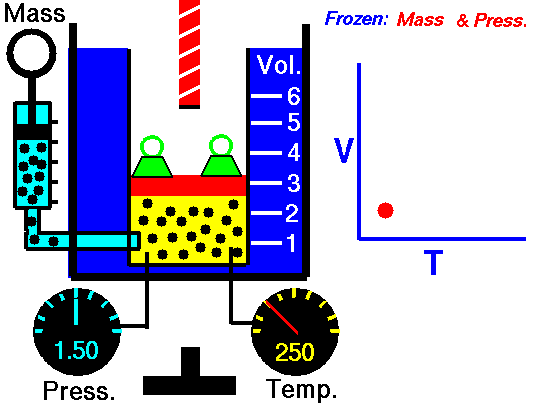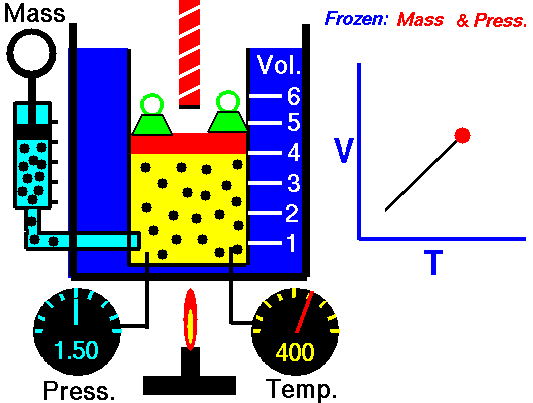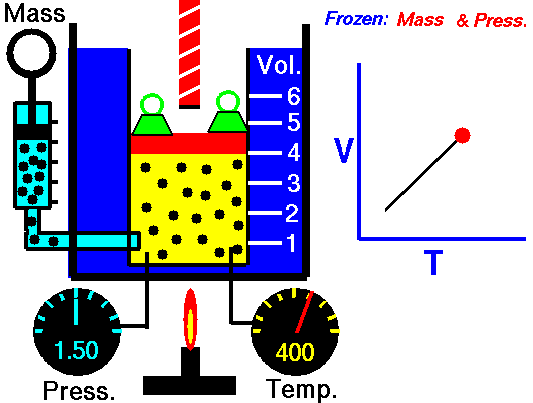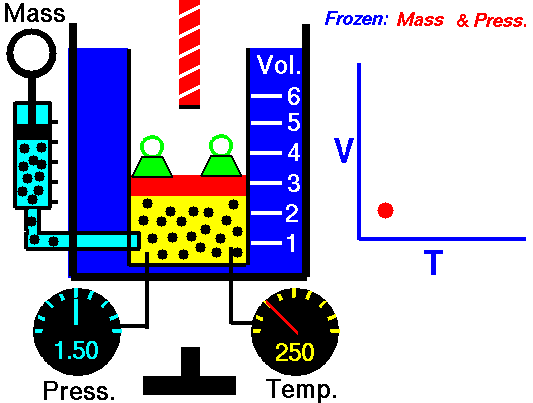
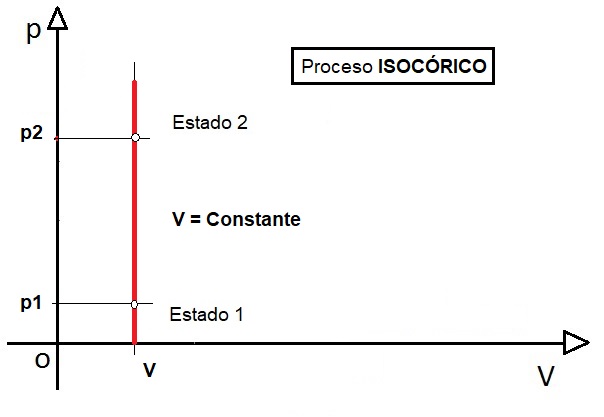
LEY DE GAY LUSSAC. Esta ley establece que, a volumen constante, la presión de un volumen fijo de un gas, es directamente proporcional a su temperatura. Su ecuación es la siguiente:
Y su representación gráfica, donde vemos que la presión aumenta al aumentar la temperatura y permanecer el volumen constante. Es el caso de una olla a presión.:
ECUACIÓN DE LOS GASES PERFECTOS. Combinando las anteriores ecuaciones, obtenemos la llamada Ecuación de los Gasos Perfectos, que nos dice que existe la siguiente relación constante entre los dos estados de un gas perfecto (muchos gases, sobre todo en instalaciones térmicas, podemos suponer que se aproximan al comportamiento de los gases perfectos):
 Este valor constante que aparece en la anteruor fórmula, se demuestra que equivale al producto de una constante R por la masa del gas en moles. Con lo que la ecuación de los gases perfectos se puede expresar, de forma general, del siguiente modo:
Este valor constante que aparece en la anteruor fórmula, se demuestra que equivale al producto de una constante R por la masa del gas en moles. Con lo que la ecuación de los gases perfectos se puede expresar, de forma general, del siguiente modo:
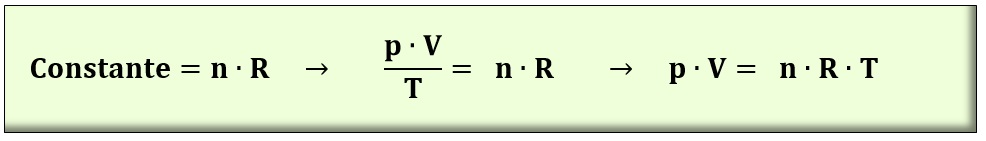
Siendo:
p1 y p2 : Presiones inicial y final del gas, en Pa
V1 y V2: Volúmenes inicial y final del gas, en m3
T1 y T2: Temperaturas inicial y final, en K (observar que no son ºC)
n: Número de moles del gas
R: Constante universal de los gases perfectos, su valor es 8,31 J/mol·K
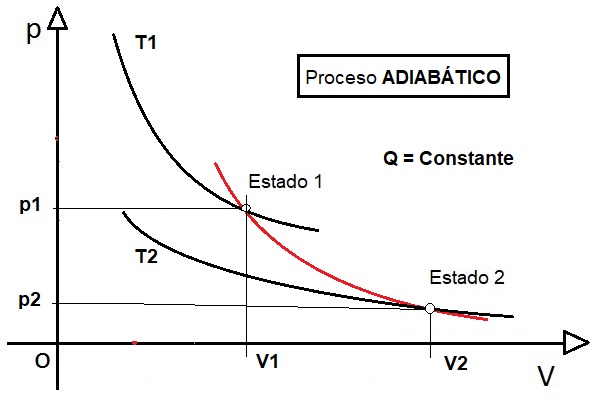
TRANSFORMACIÓN ADIABÁTICA. Un proceso termodinámico, en el que varían todas las magnitudes vistas (p, V y T), pero en el que no hay aportación ni cesión de calor, se denomina proceso adiabático. Sería una transformación en la que hay un aislamiento térmico perfecto con el exterior y no hay transferencia de calor (ni entra ni sale calor). En este tipo de transformaciones, la Ecuación de Estado vista adopta la forma:

Hay que recordar que γ es el cociente entre el calor específico a presión conntante y el calor específico a volumen constante: γ = Cp/Cv
Gráficamente, tenemos el gráfico, en el que vemos que un gas se expande, de una temperatura y presión alta,con un volumen pequeño, hasta una menor temperatura y presión, ocupando un mayor volumen (Estado 1 → Estado 2):
Todos los gases perfectos o ideales responden a la anterior relación de las variables termodinámicas fundamentales:
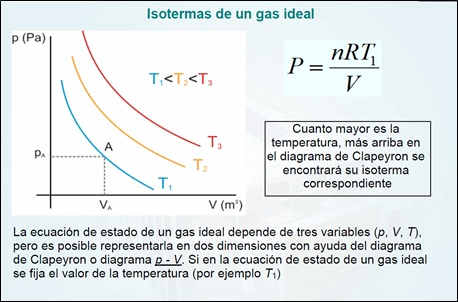
Se consideran gases perfectos o ideales aquellos en los que las fuerzas de atracción entre sus moléculas son despreciables, y el tamaño de estas en relación al volumen es infinitamente pequeño. Muchos gases tales como el nitrógeno, oxígeno, hidrógeno, gases nobles, y algunos gases pesados, tales como el dióxido de carbono (CO2), pueden ser tratados como gases ideales dentro de una tolerancia razonable. Los gases nobles son un grupo de elementos químicos con propiedades muy similares: por ejemplo, bajo condiciones normales, son gases monoatómicos, inoloros, incoloros y presentan una reactividad química muy baja. Los siete gases son helio (He), neón (Ne), argón (Ar), kriptón (Kr), xenón (Xe), el radiactivo radón (Rn) y el sintético oganesón (Og).
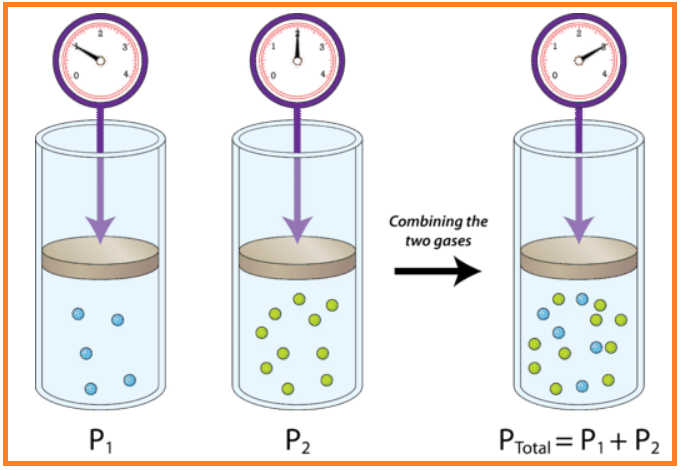
LEY DE DALTON
En una mezcla de gases, cada gas ejerce su propia presión parcial y la suma de todas es la presión total. Del total del aire atmosférico 79% lo constituye el nitrógeno (N2) y el 21% restante el oxígeno (O2). Por lo tanto de los 760 mmHg de presión atmosférica el O2 contribuye con 159 mmHg y el N2 con 601 mmHg.
CICLOS TERMODINÁMICOS
Un tipo de transformación particularmente interesante es la que se denomina ciclo, en la que el gas, después de sufrir distintas transformaciones, vuelve a su estado inicial. El interés de este tipo de transformaciones radica en que todas las máquinas térmicas y refrigeradores funcionan cíclicamente.
Cuando un ciclo se recorre en sentido horario (ver parte izquierda de la figura), el trabajo total realizado por el gas en el ciclo es positivo, ya que el trabajo AB (positivo) es mayor en valor absoluto que el BA (negativo), por lo que la suma de ambos será positiva. Por el contrario, si el ciclo se recorre en sentido antihorario el trabajo total es negativo.
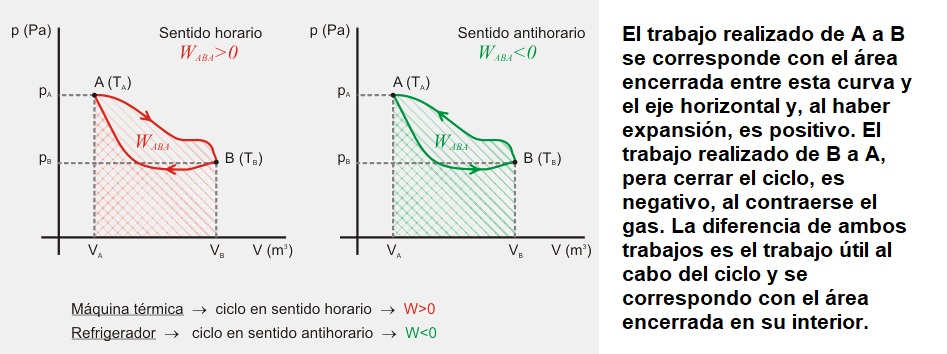
Los ciclos que representan el funcionamiento de máquinas térmicas se recorren siempre en sentido horario (una máquina da trabajo positivo), mientras que los ciclos que representan el funcionamiento de los refrigeradores son recorridos en sentido antihorario (para que un refrigerador funcione, debemos suministrarle trabajo desde el exterior).