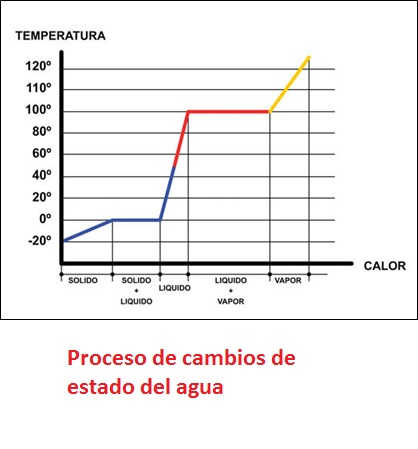
Cuando se produce un cambio de estado, por ejemplo de líquido a vapor, el calor suministrado se emplea en ese cambio de estado, permaneciendo constante la temperatura. Por ello hablamos de dos tipos de calor:
- Calor sensible es el calor que el cuerpo utiliza para aumentar su temperatura y se corresponde con los ejemplos y ejercicios vistos hasta ahora.
- Calor latente es el calor que se suministra a un cuerpo y no se aprecia en un termómetro, es decir, que no aumenta su temperatura. Toda la energía que se le suministra en forma de calor lo está empleando en realizar un cambio de estado.
El calor latente de evaporación del agua es mucho mayor que el calor sensible necesario para subir su temperatura desde los 0 ºC hasta los 100 ºC Esta propiedad, común a muchos compuestos, va a ser de mucha utilidad en varios campos de los sistemas energéticos, por ejemplo en refrigeración. En el gráfico siguiente podemos ver una combinación de calor sensible y latente, en el proceso por el que calentamos un bloque de hielo hasta conseguir vapor de agua a alta temperatura.
La tabla siguiente muestra los valores de calores latentes de fusión y de evaporación de algunas sustancias. Hay que tener presente que, si una sustancia se evapora, debe absorber el calor señalado por cada unidad de masa, pero que si se condensa, ocurre justamente lo contrario, cede este calor a su entorno. Con la fusión ocurre exactamente igual, una sustancia que se funde (pasa de sólido a líquido, debe absorber calor, mientras que una que se solidifica, cede calor al exterior. También se muestran las temperaturas a las que se producen estos cambios de estado, a la presión atmosférica normal.
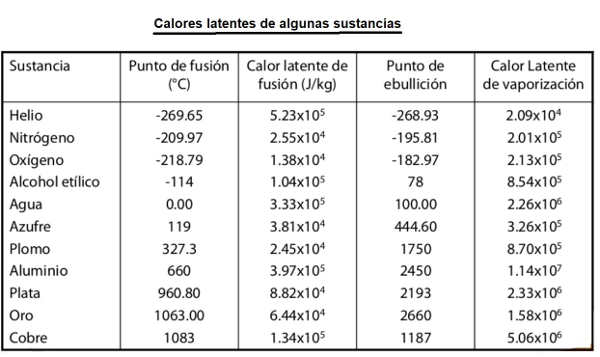
En esta tabla, tenemos las temperaturas de ebullición-evaporación de diferentes sustancias a la presión atmosférica normal. Al suministrar calor, las moléculas en estado líquido, se mueven, y son capaces de "saltar" y desunirse totalmente unas de otras y pasar al estado de vapor. A presión atmosférica, la temperatura de ebullición del agua es de 100 ºC. Sin embargo, en un monte a 3 000 m de altitud, la presión atmosférica es menor que a nivel del mar. Las moléculas de agua que pasan al estado vapor, tienen que realizar menos esfuerzo para evaporarse y, por lo tanto, lo hacen a una temperatura inferior de 100 ºC, en concreto, el agua se evapora a 89,4 ºC
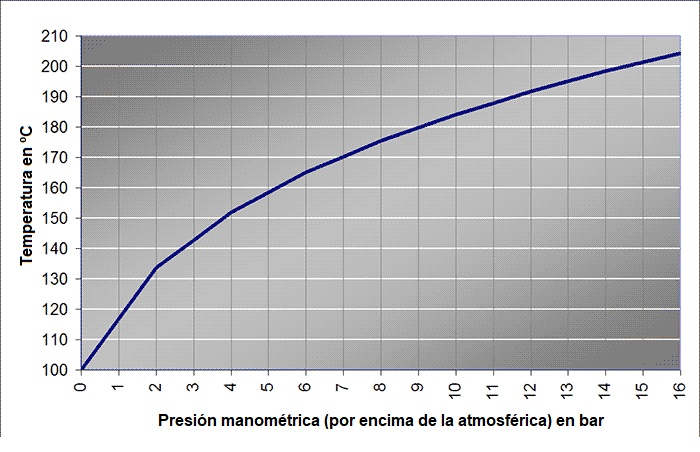
Otra situación cotidiana en la que se juega con la presión y la temperatura son las ollas a presión. A presión atmosférica sólo podemos cocinar los alimentos a 100 ºC, pero si los encerramos en una olla y aumentamos la presión interior la temperatura de cocción será superior a 100 ºC. Por este motivo se utilizan las ollas a presión: permiten cocinar a temperaturas más elevadas que un recipiente convencional y la cocción se realiza antes. A cada presión le corresponde una temperatura de evaporación o temperatura de saturación. Para el agua, esta relación, a presiones manométricas (por encima de la presión atmosférica) es: