Las reacciones de combustión no son otra cosa que reacciones químicas rápidas de oxidación de los distintos componentes del combustible, fundamentalmente carbono, hidrógeno y, a veces, azufre. El comburente es el oxigeno contenido en el aire y, menos frecuentemente, oxigeno puro. Las reacciones de combustión de estos elementos se formulan como en este ejemplo:
De forma sencilla: Carbono + Oxígeno + Chispa = Dióxido de carbono + Calor
De forma analítica: C + O2 + q → CO2 + Q
De forma numérica: C (12 g) + O2 (22,4 l) → CO2 (22,4 l) + Q (408 kJ) siendo q = 0 una vez iniciada la combustión
Recordarás que, cuando estudiaste química, un mol de carbono reacciona con un mol de oxígeno para dar un mol de CO2 y calor, 408 kJ. Y sabes que un mol es la cantidad de masa de una sustancia equivalente a su masa molecular. Es decir, 12 gramos (0,012 kg) de carbono corresponden a un mol de ese elemento. Tanto el oxígeno como el CO2 son gases, por lo que en la reacción intervienen 22,4 litros. Recuerda que un mol de un gas ocupa siempre 22, 4 litros ( 0,0224 m3 en el SI) en condiciones normales de presión y temperatura (1 atmósfera y 0 ºC).
Si el combustible es un hidrocarburo, al tener átomos de hidrógeno tendremos también la formación de vapor de agua como resultante de la reacción. Si la fórmula química de un hidrocarburo es CnHm y sabiendo que m = 2n+2, la ecuación de combustión será:
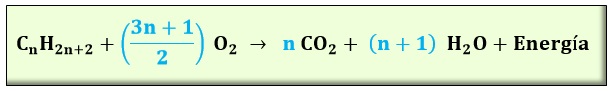
Es decir, un mol de hidrocarburo reaccionará con (3n+1)/2 moles de oxígeno, para dar n moles de CO2, n+1 moles de agua y calor. Por ejemplo, el metano CH4, es el hidrocarburo más simple y constituye el 95 % del gas natural (aproximadamente). Está compuesto por un átomo de carbono y reacciona en la combustión del siguiente modo:
CH4 + 2 O2 → CO2 + 2 H2O + Energía
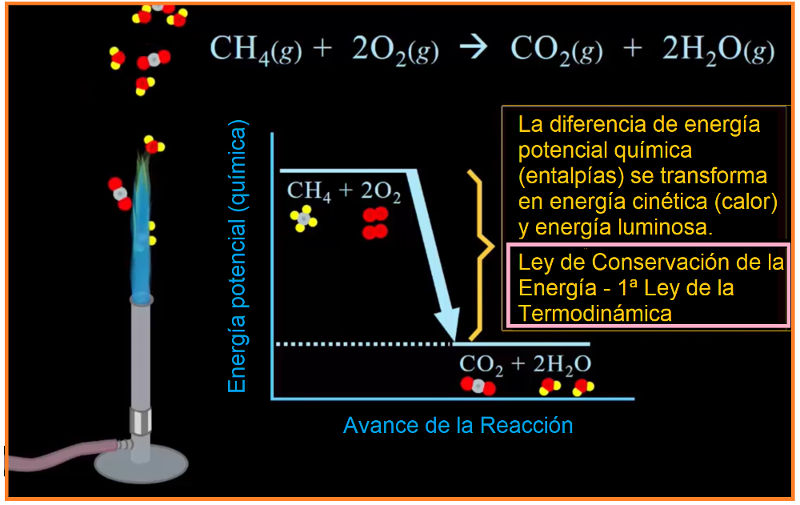
Pero, si se produce una combustión incompleta, por falta de oxígeno, la reacción puede ser la siguiente:
2 CH4 + 3 O2 → 2 CO + 4 H2O + Energía (menor cantidad)
En este último caso, hay una proporción de oxígeno menor (3/2 en lugar de 2) y se produce CO. Cuando respiramos monóxido de carbono (CO), la sangre fija esta molécula en lugar del oxígeno y sufrimos hipoxia (falta de oxígeno en nuestro cuerpo).
Teniendo en cuenta todo lo anterioir, podemos definir cuatro tipos de combustión:
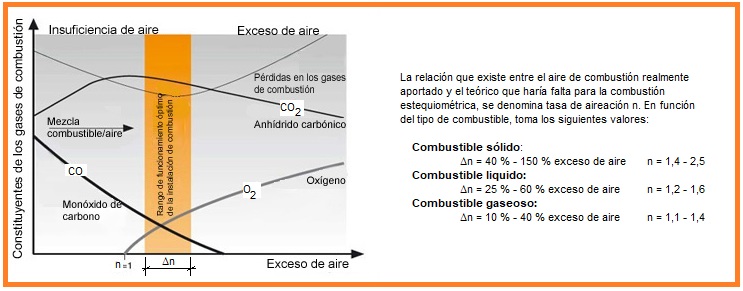
- Combustión estequiométrica Cuando la cantidad de oxígeno aportada por el aire comburente es exactamente la que se deduce de la ecuación anterior, se dice que la combustión es estequiométrica. Se produce la mayor cantidad de calor posible (Q), pero es prácticamente imposible ajustar el aporte de aire al valor deducido por la ecuación.
- Combustión completa con exceso de aire. En este caso, al ser mayor la cantidad de oxigeno que entra en la reacción que la estequiométricamente necesaria, el resultado es que en los productos de la combustión tenemos además del CO2 y del agua, el exceso de aire que no reacciona. En esta reacción, como parte del calor desprendido se emplea en calentar el exceso de aire existente, la temperatura que se obtiene es menor que la que se obtendría en una combustión estequiométrica.
- Combustión incompleta con defecto de aire. Al no existir oxígeno suficiente para oxidar todo el carbono y el hidrógeno contenidos en el combustible, se obtiene óxido de carbono e hidrógeno, además de los productos de la combustión estequiométrica. La cantidad de calor obtenida también es menor que en la reacción estequiométrica.
- Combustión incompleta con exceso de aire. Si en una combustión no hay una buena mezcla entre sus componentes, se producen reacciones en las que queda carbono e hidrógeno sin oxidar completamente, así como oxígeno sin reaccionar pues no llega a quemar todo el hidrocarburo, desaprovechándose parte de su energía.
En la práctica las combustiones estequiométricas son difíciles de conseguir ya que exigirían una mezcla íntima entre el combustible y el aire, así como un aporte exacto de éste último. Por ello se prefiere que haya un exceso de aire controlado a fin de asegurar la oxidación total del combustible. La pérdida de calor que supone el calentamiento del aire en exceso es un perjuicio menor del que supondría una combustión incompleta con la consiguiente producción de inquemados (hollín y CO).
El mol (símbolo: mol) es la unidad con que se mide la cantidad de sustancia, una de las siete magnitudes físicas fundamentales del Sistema Internacional de Unidades.
Los Hidrocarburos son compuestos orgánicos conformados únicamente por átomos de carbono e hidrógeno.
la hipoxia es un estado de deficiencia de oxígeno en la sangre, células y tejidos del organismo, con compromiso de la función de los mismos.
Combustión estequiométrica o neutra: es una combustión completa en la que se ha empleado la cantidad exacta de aire obtenida a partir de las relaciones cuantitativas de las moléculas que intervienen en cada reacción. En realidad se trata de una combustión ideal, que solo puede conseguirse en laboratorio
Combustión estequiométrica o neutra: es una combustión completa en la que se ha empleado la cantidad exacta de aire obtenida a partir de las relaciones cuantitativas de las moléculas que intervienen en cada reacción. En realidad se trata de una combustión ideal, que solo puede conseguirse en laboratorio